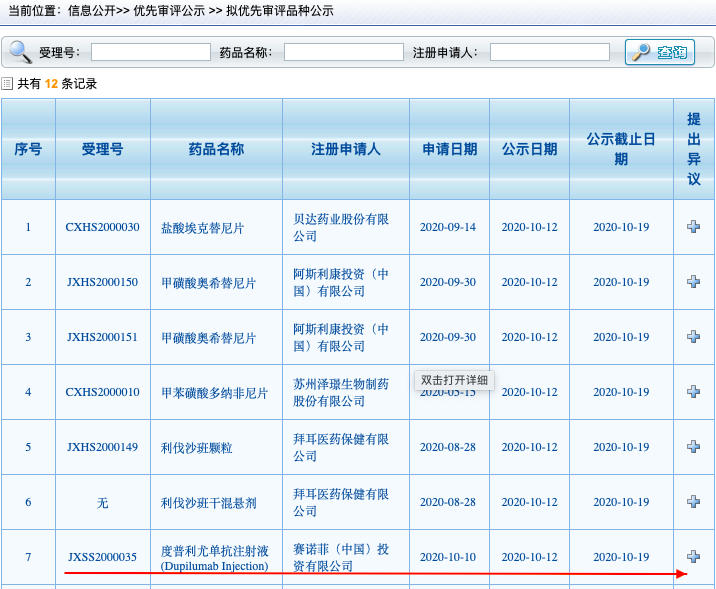
10月12日,中国国家药监局药品审评中心(CDE)网站公示,5款新药上市申请拟纳入优先审评。其中包括赛诺菲(Sanofi)"双靶点"抗体度普利尤单抗(dupilumab)。
来源:CDE
度普利尤单抗是赛诺菲和再生元(Regeneron)联合开发的一款全人单克隆抗体,能够通过“双靶点”的创新作用机制,选择性地抑制关键信号通路白介素4(IL-4)和白介素13(IL-13),阻断2型炎症通路,降低2型炎症的病理性反应,从机制上治疗2型炎症相关疾病。根据赛诺菲早前发布的新闻稿,该药是FDA批准的首个IL-4Rα抗体和首个用于中重度特应性皮炎的生物制品。
在中国,度普利尤单抗是临床急需境外新药之一,已于今年6月获批用于治疗成人中重度特应性皮炎。此次度普利尤单抗新适应症上市申请以符合儿童生理特征的儿童用药品新品种、剂型和规格的理由拟纳入优先审评,拟开发用于治疗外用处方药控制不佳或不建议使用外用处方药的12岁及以上青少年和成人中重度特应性皮炎。